Попри те, що міжнародні клінічні випробування (дослідження) в Україні проводяться вже понад 25 років, ця сфера для пересічного громадянина все ще є «таємницею за сімома печатками». Брак доступної інформації, це зазвичай породжує низку домислів та стереотипів, залишаючи чимало незрозумілих аспектів. На цій сторінці спробуємо відповісти на типові питання, які постають у пацієнтів та лікарів, роз’яснити та розвіяти сумніви, міфи, стереотипи. Список питань та відповідей на них постійно доповнюватиметься, даючи змогу читачу замислитися над питанням у заголовку цієї публікації та зробити власні висновки про дослідження.
Попри те, що міжнародні клінічні випробування (дослідження) в Україні проводяться вже понад 25 років, ця сфера для пересічного громадянина все ще є «таємницею за сімома печатками». Брак доступної інформації, це зазвичай породжує низку домислів та стереотипів, залишаючи чимало незрозумілих аспектів. На цій сторінці спробуємо відповісти на типові питання, які постають у пацієнтів та лікарів, роз’яснити та розвіяти сумніви, міфи, стереотипи. Список питань та відповідей на них постійно доповнюватиметься, даючи змогу читачу замислитися над питанням у заголовку цієї публікації та зробити власні висновки про дослідження.
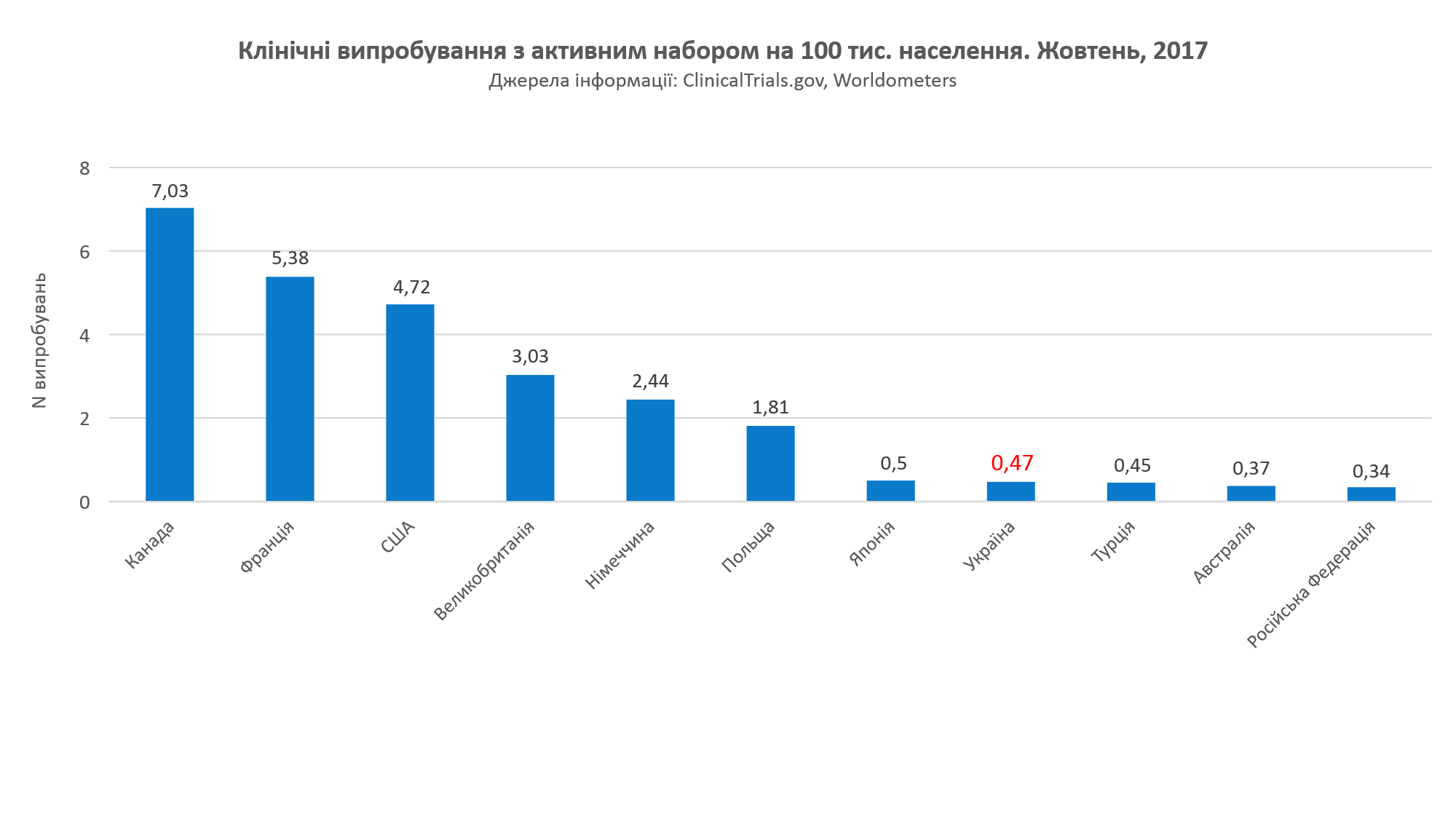
Для початку зверніть увагу на цікаву статистику: клінічні випробування на 100 тис. населення – Україна помітно відстає від країн з розвинутою економікою (2007 р.).
Яка мета проведення випробувань?
Яка мета проведення випробувань?
Довести ефективність та безпечність нового лікарського засобу та дозволити його широке застосування пацієнтами з хворобою, для лікування якої його було розроблено. На щастя, наука не стоїть на місці, але кількість невиліковних захворювань, на жаль, залишається досить великою. Це вимагає пошуку нових, кращих та безпечніших ліків, нових рішень, нових підходів до лікування хвороби з метою подовження життя людей та покращення його якості. Безперечно, до того моменту, коли лікарський засіб доходить до етапу застосування людиною, він вже успішно пройшов роки експериментальних розробок, хімічних та лабораторних дослідів, фазу дослідження на експериментальних моделях хвороби у тварин, засвідчивши свою ефективність та безпеку, показавши свій профіль дії. Тобто, ключові характеристики нової речовини глибоко вивчаються, і на етапі застосування людиною дія препарату вже є досить прогнозованою, однак жоден лікарський засіб в цивілізованому світі не може бути зареєстровано без результатів клінічних досліджень. Саме тому, на групах пацієнтів (загалом по світу: сотні – десятки тисяч в залежності від фази конкретного дослідження) слід уточнити як поводить себе медпрепарат саме у людському організмі, у яких дозах він є найбільш ефективним, а також якомога ретельніше вивчити новий лікарський засіб аби дозволити його застосування широкими верствами населення, яке страждає на певну патологію.
Хто може брати участь?
Хто може брати участь?
Детальні характеристики осіб, яких планується залучити до конкретного дослідження прописано у протоколі клінічного випробування – а саме у розділі про критерії добору (так звані, критерії включення та виключення). До таких критеріїв належать зазвичай стать, вік, певне захворювання, його стадія і тривалість, особливості попереднього лікування, відсутність певних супутніх патологій тощо.
Здорові добровольці запрошуються до досліджень першої фази, тобто коли препарат вперше вивчається на людях – головною метою дослідження є вивчення його безпеки в організмі людини.
Дорослі категорії населення (віковий діапазон зазначено в протоколі) з певною хворобою, наявність якої підтверджено або ні.
Діти різних вікових категорій (за певних умов, прописаних у протоколі)
Особи з обмеженими можливостями (за певних умов, прописаних у протоколі)
У клінічних дослідженнях можуть брати участь як жінки, так і чоловіки. Варто зазначити, що можуть мати місце певні умови, обмеження чи застереження під час участі у дослідженні, пов’язані зі статтю, наприклад, критерієм виключення в багатьох дослідженнях є вагітність і годування груддю, тому що невідомо, як препарат може вплинути на здоров’я плоду чи новонародженого, потрапляючи в його організм через плаценту чи грудне молоко, а отже ризики щодо перебігу вагітності та щодо потенційного впливу препарату на плід, зазвичай переважають користь, яку може отримати жінка від участі у дослідженні. Жінки репродуктивного віку, включені в клінічні дослідження, повинні використовувати надійні методи контрацепції, іноді це стосується і чоловіків.
Хто та де проводить дослідження?
Хто та де проводить дослідження?
Клінічні дослідження проводиться дослідниками. Дослідник – це досвідчений лікар-спеціаліст високої кваліфікації, який працює у медичному закладі та відповідає за проведення клінічного дослідження у команді лікарів-дослідників, медсестер, координаторів, та інших кваліфікованих спеціалістів після позитивного висновку Державного Експертного Центру МОЗ України (ДЕЦ) та Незалежних Етичних Комісій при медичних закладах щодо протоколу дослідження, супутніх документів та процедур.
Як відбувається відбір дослідників та медичних закладів?
Як відбувається відбір дослідників та медичних закладів?
Дослідники та медичні заклади (як державні, так все більше з’являється і передових приватних), де проводяться клінічні випробування, проходять суворий відбір, їх участь у кожному дослідженні щоразу потребує окремої офіційної ухвали від команди спеціалістів фармацевтичної компанії-виробника лікарського засобу, що досліджується, а також експертів ДЕЦ після детального вивчення їх кваліфікації, досвіду, організаційних можливостей для проведення клінічного випробування згідно з міжнародними стандартами якості. До участі у клінічних випробуваннях допускаються спеціалісти, які пройшли відповідну підготовку згідно зі стандартами Належної клінічної практики (ICH GCP) та отримали відповідний Сертифікат. Серед них багато лікарів з науковим ступенем, професорів, завідувачів відділень, вчених, увагу яких зосереджено на інноваціях у лікуванні конкретної патології.
В усіх країнах, де проходять міжнародні клінічні випробування, суворо дотримуються аналогічних процедур щодо розгляду документації та допущення безпосередніх виконавців до проведення кожного дослідження.
Якість роботи дослідників та медичних закладів, а також відповідність проведення випробувань сучасним міжнародним стандартам регулярно контролюється як місцевими регуляторними органами (планові та позапланові інспекції ДЕЦ), так і міжнародними незалежними аудиторами та інспекторами, а також представниками фармацевтичної компанії – виробника лікарського засобу, що досліджується.
Чи достатньо лише бажання та згоди пацієнта?
Чи достатньо лише бажання та згоди пацієнта?
Ні.
Окрім власного бажання та підписання інформованої згоди хворим та (у деяких випадках) його законним представником, задля участі у КД необхідною умовою є повна відповідність критеріям добору (вони різні у кожному дослідженні, наприклад: вік, ступінь важкості хвороби, супутні захворювання, лікування). Про інформовану згоду пацієнта детальніше можна прочитати тут.
Чи має право пацієнт достроково припинити свою участь ?
Чи має право пацієнт достроково припинити свою участь ?
Так.
Пацієнт має право припинити участь у випробуванні за власним бажанням у будь-який момент, сповістивши про це дослідника – лікаря медичного закладу, який відвідує пацієнт під час участі у дослідженні. Припинення участі у дослідженні не має впливу на якість лікування захворювання поза межами дослідження в умовах звичайної практики, хворий отримуватиме адекватне лікування та медичне спостереження відповідно до його стану згідно з чинним законодавством України. Про інформовану згоду пацієнта детальніше можна прочитати тут.
Чи отримає хворий користь від участі у випробуванні?
Чи отримає хворий користь від участі у випробуванні?
Так.
- Участь у клінічному випробуванні дає шанс хворому безплатно спробувати інноваційне, ніде більше недоступне лікування його хвороби, яке може виявитися більш ефективним та супроводжуватися меншою кількістю небажаних побічних явищ, ніж поточне схвалене стандартне лікування широко відомими зареєстрованими лікарськими засобами. Трапляється навіть і так, що досліджуваний засіб стає проривом у лікуванні певної хвороби, рятуючи життя, подовжуючи його, значно поліпшуючи його якість. Приклад: середній період тривалості життя пацієнтів з лейкемією, лімфомою, раком нирки, простати, шлунку, молочної залози зріс на третину станом на 2012 рік у порівнянні з 80-ми роками. Досягти таких результатів допомогли інноваційні ліки, які випробовувалися в клінічних дослідженнях. Багато отримали їх, не очікуючи реєстрації.
- Участь дає хворому можливість прискорити реєстрацію, а отже, широкий доступ до новітнього ефективного лікування поза межами клінічних випробувань. Це приносить користь самому пацієнту та широкому колу людей з аналогічною хворобою по всьому світу. Україна нещодавно ухвалила закон про спрощений допуск на наш ринок препаратів, зареєстрованих у США, Канаді, Швейцарії, Японії та ЄС.
- Участь дозволяє хворому отримати всебічне обстеження організму. Результати такого обстеження можуть виявити супутні захворювання, а отже, є можливість вжити своєчасних належних заходів щодо їх лікування на ранніх стадіях.
- Участь супроводжується ретельним лікарським наглядом за хворим та будь-якими змінами у стані його здоров’я, результатами лабораторних та інструментальних досліджень, а отже, пацієнт вчасно отримує повну інформацію про динаміку свого захворювання та рекомендації щодо його подальшого лікування.
Чи закінчується прийняття досліджуваного лікарського засобу разом з завершенням дослідження?
Чи закінчується прийняття досліджуваного лікарського засобу разом з завершенням дослідження?
Так.
- Але випробування може бути багаторічним.
- Прийняття лікарського засобу, який був ефективним в одному клінічному дослідженні, може бути подовжено в наступному дослідженні.
Чи мають місце ризики та незручності під час участі?
Чи мають місце ризики та незручності під час участі?
Так.
Але ризики є керованими, а незручності компенсуються. Керованість ризиків означає наявність дієвих механізмів по їх попередженню та мінімізації впливу наслідків.
До основних ризиків належать:
Ризик не отримати бажаного результату під час лікування досліджуваним препаратом. Цей ризик частково компенсується тим, що період, під час якого пацієнт може не отримати ніякого лікування взагалі (у плацебо-контрольованих дослідженнях), є досить недовгим. Також дуже поширеною практикою у дослідженнях є порівняння досліджуваного лікарського засобу з сучасними зареєстрованими ліками, якими зазвичай лікують хворобу. Досліджуваний має ризик не отримання бажаного результату під час лікування, або має можливість отримати у клінічному випробуванні ефект, кращий від застосування сучасного зареєстрованого препарату, або отримати сучасне лікування зареєстрованим лікарським засобом.
Ризик появи небажаних побічних явищ під час лікування досліджуваним препаратом (слід зазначити, що під час лікування зареєстрованим препаратом, такий ризик зберігається, але кожна інструкція містить детальний перелік відомих побічних явищ, тоді як на етапі дослідження ще не про всі реакції на препарат відомо).
Яким чином мінімізуються ризики побічних явищ?
- Експерти команди спеціалістів Замовника під час написання протоколу дослідження, а також експерти Державного Експертного центру МОЗ України, розглядають всі документи дослідження, де прописано, зокрема мету і процедури дослідження та надано вичерпну інформацію про досліджуваний засіб, зважують користь і ризик для пацієнта, дивляться, чи не було виявлено за результатами до клінічних досліджень препарату чогось, що може нашкодити пацієнту, і не ухвалюють проведення дослідження у випадку, якщо очікувані користь та всі ризики клінічного випробування не збалансовано.
- Безпосередньо перед участю у клінічному випробуванні дослідник інформує пацієнта письмово та усно про всі можливі й наразі відомі побічні реакції на досліджуваний лікарський засіб. Отже, пацієнт має змогу зважити наскільки ці побічні явища є значущими індивідуально для нього та має право відмовитися від участі у дослідженні як до його початку, так і згодом по ходу дослідження, якщо його будуть надто сильно турбувати побічні явища.
- Пацієнт під час участі у дослідженні знаходиться під пильним лікарським наглядом. Якщо під час дослідження лікар-дослідник бачить ситуацію, коли ризики для пацієнта помітно перевищують користь від участі, він має право виключити пацієнта з дослідження, оскільки це відповідатиме найліпшим інтересам з точки зору його здоров’я.
- Фармакологічна компанія (спонсор дослідження) обов’язково страхує здоров’я досліджуваного в одній з українських страхових компаній на випадок можливої шкоди, завданої здоров’ю пацієнта, яку буде компенсовано кожному пацієнту згідно зі страховим договором.
Незручності, зазвичай, стосуються необхідності частого відвідування медичного закладу пацієнтом під час участі у клінічному випробуванні, особливо на його початку. Іноді навіть потрібно побути деякий час у лікарні, але згодом по ходу дослідження, частота візитів до медичного закладу зменшується, частина візитів замінюється телефонними контактами згідно з вимогами протоколу. Іноді трапляється так, що найближчий медичний заклад, де проводиться клінічні випробування, знаходиться досить далеко від пацієнта, можливо навіть в іншому місті. У такому випадку пацієнт може отримати компенсацію витрат на транспорт. Також до списку поширених незручностей відносяться складнощі з перенесенням візиту на кілька днів (візити мають відбуватися за графіком), а також необхідність дуже детального та термінового сповіщення дослідника про будь-які зміни у стані здоров’я, про можливі призначення ліків іншими лікарями, і т.ін. Отже, участь у дослідженні потребує високий ступінь самодисципліни з боку пацієнта.
Чи оплачується участь?
Чи оплачується участь?
Оплачуватися може тільки участь добровольця у Фазі І випробування (досліджуваний препарат вперше приймається людиною).
- Всі лабораторні та інструментальні обстеження та лікування у клінічному випробуванні є безплатними для пацієнта.
- Суттєві дорожні витрати учасника, пов’язані з візитами в місце проведення випробування, можуть бути компенсовані в клінічному випробуванні.
Чи здійснюється контроль за проведенням досліджень в Україні?
Чи здійснюється контроль за проведенням досліджень в Україні?
Так.
Перед початком клінічного дослідження Державний Експертний Центр МОЗ України надає дозвіл на його проведення, а також свій позитивний висновок надає незалежна етична комісія при кожній медичній установі, де планується проведення випробування, після ретельного розгляду документів Замовника.
У ході дослідження та ще довгий час після його завершення проводиться низка планових та позапланових «контрольних перевірок якості» (аудитів та інспекцій), як представниками Замовника, Контрактної дослідницької організації, незалежної аудиторської компанії, інспекторами ДЕЦ України, так й інспекторами провідних у світі регуляторних органів (Европейська Медична Агенція (ЕМА) у співпраці з регуляторною агенцією США (FDA).