Несмотря на то, что международные клинические исследования (испытания, КИ) в Украине проводятся уже более 25 лет, данная сфера для обычного гражданина все еще является «тайной за семью печатями». Нехватка доступной информации, как правило, порождает ряд домыслов и стереотипов, оставляя немало неясных аспектов. На этой странице попробуем ответить на типичные вопросы, которые возникают у пациентов и врачей, разъяснить и развеять сомнения, мифы, стереотипы. Список вопросов и ответов на них будет постоянно дополняться, позволяя читателю задуматься над вопросом в заголовке данной публикации и сделать собственные выводы об испытаниях.
Несмотря на то, что международные клинические исследования (испытания, КИ) в Украине проводятся уже более 25 лет, данная сфера для обычного гражданина все еще является «тайной за семью печатями». Нехватка доступной информации, как правило, порождает ряд домыслов и стереотипов, оставляя немало неясных аспектов. На этой странице попробуем ответить на типичные вопросы, которые возникают у пациентов и врачей, разъяснить и развеять сомнения, мифы, стереотипы. Список вопросов и ответов на них будет постоянно дополняться, позволяя читателю задуматься над вопросом в заголовке данной публикации и сделать собственные выводы об испытаниях.
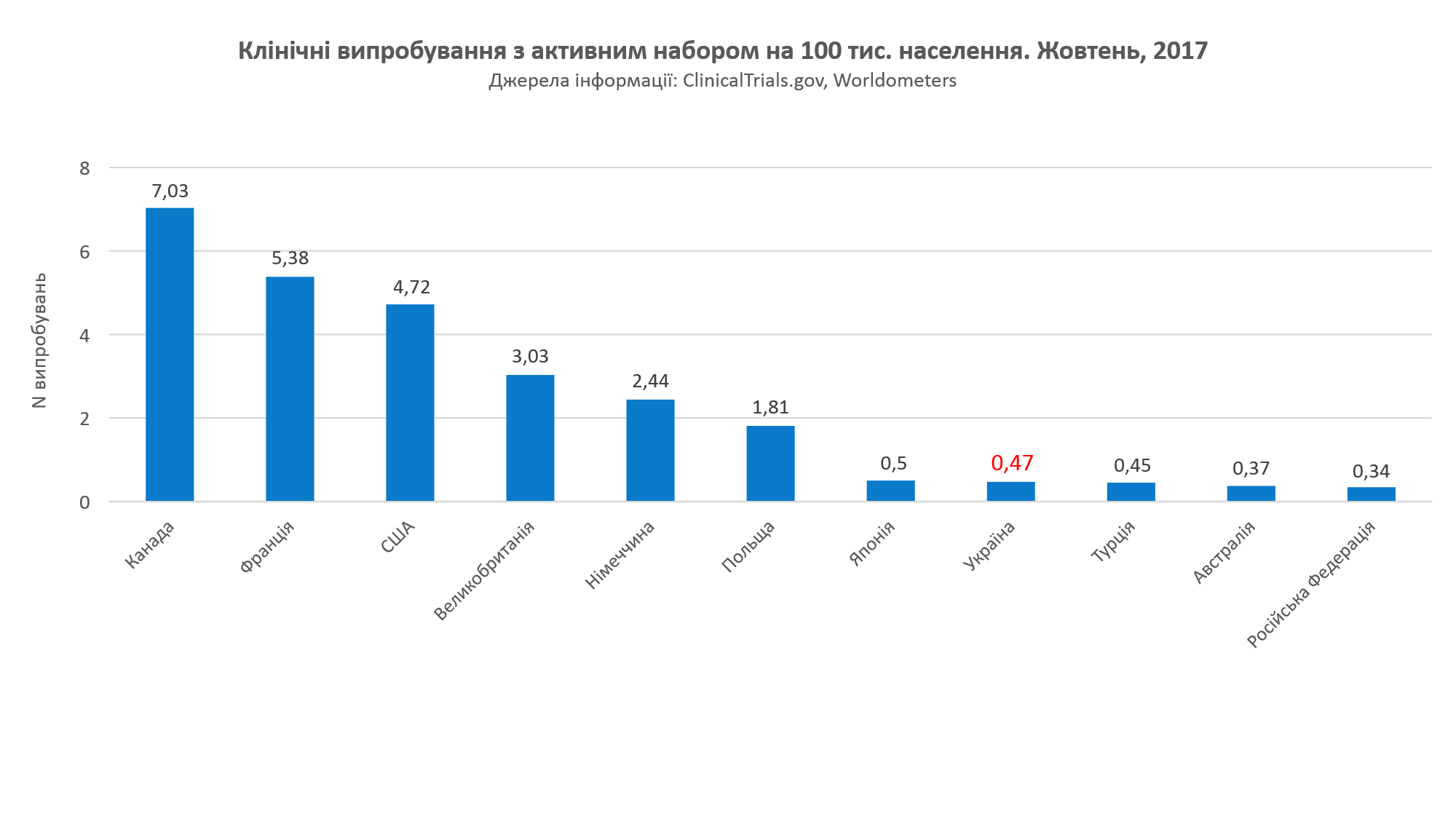
Для начала обратите внимание на интересную статистику: КИ на 100 тыс. населения – Украина заметно уступает странам с развитой экономикой (2007 г.).
Какая цель проведения исследований?
Какая цель проведения исследований?
Доказать эффективность и безопасность нового лекарственного средства и получить разрешение на его широкое применение пациентами с заболеванием, для лечения которого он был разработан. К счастью, наука не стоит на месте, однако и количество неизлечимых заболеваний, к сожалению, остается довольно больших. Это требует поиска новых, лучших и более безопасных лекарств, новых решений, новых подходов к лечению болезни с целью продления жизни человека и улучшения ее качества. Бесспорно, до того момента, когда лекарственный препарат доходит до этапа использования человеком, он уже успешно прошел годы экспериментальных разработок, химических и лабораторных опытов, фазу испытаний на экспериментальных моделях болезни у животных, засвидетельствовав свою эффективность и безопасность, показав свой профиль действия. То есть, ключевые характеристики нового вещества глубоко изучаются, и на этапе применения человеком действие препарата уже довольно прогнозировано, однако ни одно лечебное средство в цивилизованном мире не может быть зарегистрирован без результатов клинических исследований. Именно поэтому, на группах испытуемых (в целом по миру: сотни – десятки тысяч в зависимости от фазы конкретного испытания) следует уточнить как ведет себя медпрепарат непосредственно в организме человека, в каких дозах он наиболее эффективен, а так же как можно подробнее изучить новое медицинское средство для того, чтобы допустить его применение в широких кругах населения, которое страдает определенной патологией.
Кто может принимать участие?
Кто может принимать участие?
Характеристики лиц, которых планируется включать в конкретное исследование, подробно прописаны в протоколе КИ – а именно в разделе о критериях отбора (так называемые, критерии включения и исключения). К таким критериям обычно относятся пол, возраст, определенное заболевание, его стадия и продолжительность, особенности предыдущего лечения, отсутствие определенных сопутствующих патологий, и т.п.
Здоровые добровольцы приглашаются в клинические исследования первой фазы, то есть когда препарат впервые изучается на людях – главной целью исследования является изучение его безопасности в организме человека.
Взрослые категории населения (возрастной диапазон указан в протоколе) с определенным заболеванием, наличие которого подтверждено либо нет.
Дети различных возрастных категорий (при определенных условиях, прописанных в протоколе)
Особы с ограниченными возможностями (при определенных условиях, прописанных в протоколе)
В КИ могут участвовать как женщины, так и мужчины. Следует отметить, что могут существовать определенные условия, ограничения или меры предосторожности на период участия в исследовании, связанные с полом, например, критерием исключения в большинстве исследований является беременность и кормление грудью, потому как неизвестно, как препарат может повлиять на здоровье плода или новорожденного, попадая в его организм через плаценту или грудное молоко, а следовательно риски в отношении течения беременности и потенциального влияния препарата на плод, как правило, преобладают над пользой, которую может получить женщина, участвуя в исследовании. Женщины репродуктивного возраста, включенные в клинические исследования, должны использовать надежные методы контрацепции, иногда это касается и мужчин.
Кто и где проводит испытания?
Кто и где проводит испытания?
КИ проводятся исследователями. Исследователь – это опытный врач-специалист высокой квалификации, который работает в медицинском учреждении и отвечает за проведение клинического исследования в команде врачей-исследователей, медсестер, координаторов, и других квалифицированных специалистов после положительного заключения Государственного Экспертного Центра МЗО Украины и Независимых Этических Комиссий при медицинских учреждениях относительно протокола испытания, сопутствующих документов и процедур.
Как происходит отбор исследователей и медицинских учреждений?
Как происходит отбор исследователей и медицинских учреждений?
Исследователи и медицинские учреждения (как государственные, так и все больше появляется и передовых частных), где проводятся клинические исследования, проходят строгий отбор, их участие в каждом исследовании требует каждый раз отдельного одобрения командой специалистов фармацевтической компании-производителя исследуемого лекарственного средства, а также экспертов Государственного Экспертного Центра после подробного изучения вопросов их квалификации, опыта, организационных возможностей для проведения клинического испытания соответственно международным высоким стандартам качества. В клинических исследованиях допускаются специалисты, которые прошли соответствующую подготовку по стандартам Надлежащей клинической практики (ICH GCP) и получили соответствующий Сертификат, среди них много врачей с ученой степенью, профессоров, заведующих отделениями, ученых, работающий в области инноваций в лечении конкретной патологии.
Во всех странах, где продятся межународные КИ, строго соблюдаются аналогичные процедуры относительно рассмотрения документации и допуска непосредственных исполнителей к проведению каждого испытания.
Качество работы исследователей и медицинских учреждений, а также соответствие процедур современным международным стандартам регулярно контролируется как местными регуляторными органами (плановые и внеплановые инспекции Государственного Экспертного Центра), так и международными независимыми аудиторами и инспекторами, а также представителями фармацевтической компании – производителя исследуемого лекарственного средства.
Достаточно ли только желания и согласия пациента?
Достаточно ли только желания и согласия пациента?
Нет.
Помимо собственного желания и подписания информированного согласия больным и (в некоторых случаях) его законным представителем, для участия в КИ необходимым условием является полное соответствие критериям включения (они разные в каждом испытании, например, возраст, степень тяжести заболевания, сопутствующие болезни, и их лечение). Об информированном согласии пациента подробнее можно прочесть здесь.
Имеет ли право пациент досрочно прекратить свое участие?
Имеет ли право пациент досрочно прекратить свое участие?
Да.
Испытуемый имеет право прекратить участие в КИ по собственному желанию в любой момент, сообщив об этом исследователю – врачу медицинского учреждения, которое посещает пациент в рамках участия в исследовании. Прекращение участия в исследовании не влияет на качество лечения заболевания за пределами испытания в условиях рутинной практики, больной будет получать надлежащее лечение и медицинское обследование соответственно его состоянию согласно действующему законодательству Украины. Об информированном согласии пациента подробнее можно прочесть здесь.
Получает ли больной пользу от участия в КИ?
Получает ли больной пользу от участия в КИ?
Да.
- Участие в КИ дает шанс больному бесплатно опробовать инновационное лечение, которое может оказаться более эффективным и с меньшим количеством нежелательных побочных явлений, нежели текущее одобренного стандартное лечение широко известными зарегистрированными лекарственными средствами. Бывает даже так, что исследуемый препарат становится прорывом в лечении определенного заболевания, спасая пациентов, продлевая жизнь, значительно улучшая ее качество. Пример: средняя продолжительность жизни пациентов с лейкемией, лимфомой, раком почек, простаты, желудка, молочной железы вырос на треть по состоянию в 2012 году по сравнению с 1980-ми годами. Достичь таких результатов помогли инновационные препараты, изучавшиеся в КИ. Многие получали их без ожидания регистрации.
- Участие позволяет больному ускорить регистрацию препарата, а, следовательно, широкий доступ к новейшему эффективному лечению уже за рамками клинических исследований. Это приносит пользу непосредственно самому пациенту и широкому кругу людей с аналогичным заболеванием во всем мире. Поскольку известно, что, если исследуемый препарат подтвердил свою высокую эффективность, то процедура его регистрации ускоряется. Украина недавно приняла закон об упрощенном допуске на рынок препаратов, зарегистрированных в США, Канаде, Швейцарии, Японии и ЕС.
- Участие позволяет больному обследовать организм всесторонне. В результате такого обследования могут быть выявлены сопутствующие заболевания, а следовательно, есть возможность предпринять своевременные надлежащие меры по их лечению на ранних стадиях.
- Участие сопровождается тщательным медицинским контролем состояния больного и любых изменений в состоянии его здоровья, результатах лабораторных и инструментальных исследований, а следовательно, пациент своевременно получает полную информацию о динамике своего заболевания и рекомендации относительно его дальнейшего лечения.
Заканчивается ли прием исследуемого лекарственного средства вместе с завершением испытания?
Заканчивается ли прием исследуемого лекарственного средства вместе с завершением испытания?
Да.
- Но клиническое испытание может быть и многолетним.
- Прием лекарственного средства, которое показало эффективность в одном КИ, может быть продолжен в следующем испытании данного лекарственного средства.
Имеют ли место риски и неудобства во время участия?
Имеют ли место риски и неудобства во время участия?
Да.
Однако риски управляемы, а неудобства компенсируются. Управляемость рисков означает наличие эффективных механизмов их предотвращения или минимизации последствий.
К основным рискам относятся:
Риск не получить желаемый результат во время лечения исследуемым препаратом. Данный риск частично компенсируется тем, что период, во время которого пациент может не получать какого-либо лечения вообще (в плацебо-контролированных исследованиях), является довольно коротким. А также очень часто в испытании новый препарат сравнивается с современным зарегистрированным средством, при помощи которого обычно лечат заболевание. Испытуемый имеет риск не получить желаемый результат во время лечения в рамках клинического исследования, или имеет возможность получить эффект лучше, чем при лечении современным зарегистрированным препаратом, или получить современное лечение зарегистрированным препаратом.
Риск нежелательных побочных явлений во время лечения исследуемым препаратом. Следует отметить, что во время лечения зарегистрированным препаратом такой риск сохраняется, однако в каждой инструкции содержится подробный перечень известных побочных явлений, тогда как на этапе испытания еще не все побочные реакции на препарат известны.
Каким образом минимизируются риски побочных явлений?
- Эксперты команды специалистов Заказчика на момент написания протокола клинического исследования, а также эксперты Государственного Экспертного центра МЗО Украины, рассматривают все документы, в которых прописаны, в частности цели и процедуры испітания и предоставлена исчерпывающая информация об исследуемом препарате. Они взвешивают риск для пациента, выясняют, не было ли выявлено по результатам доклинических испытаний чего-либо, что может навредить пациенту. Они не одобряют проведение исследования в случае, если ожидаемые польза и все риски клинического исследования не сбалансированы.
- Непосредственно перед участием в КИ исследователь информирует больного письменно и устно обо всех возможных и к настоящему времени известных побочных реакциях на исследуемый препарат. Следовательно, у пациента есть возможность взвесить насколько эти побочные явления имеют значение лично для него и также право отказаться от участия в исследовании как до его начала, так и со временем по ходу испытания, если его будут слишком сильно беспокоить побочные явления.
- Испытуемый во время участия в исследовании находится под пристальным медицинским наблюдением. Если во время исследования врач-исследователь видит ситуацию, когда риски для пациента заметно превышают пользу от участия, он имеет право исключить пациента из испытания, поскольку это будет соответствовать его наилучшим интересам с точки зрения здоровья.
- Фармакологическая компания (спонсор испытания) обязательно страхует здоровье испытуемого в одной из украинских страховых компаний на случай возможного ущерба здоровью пациента, который будет компенсироваться каждому пациенту согласно страховому договору.
Неудобства, как правило, касаются необходимости частого посещения медицинского учреждения пациентом во время участия в клиническом исследовании, особенно на его начальных этапах. Иногда даже нужно будет находиться определенное время в больнице, но со временем по ходу исследования, частота визитов в медицинское учреждение уменьшается, часть из них заменяется телефонными контактами согласно протоколу. Иногда случается так, что ближайшее медицинское учреждение, где проводится КИ, находится довольно далеко от пациента, возможно даже в другом городе. В таком случае испытуемый может получить компенсацию транспортных затрат. Также к списку распространенных неудобств относятся сложности с переносом визита на несколько дней (визиты должны происходить по расписанию), а также необходимость очень подробного и своевременного оповещения исследователя о каких-либо изменениях в состоянии здоровья, о возможных назначениях препаратов другими врачами, і т.п. Следовательно, участие в КИ требует высокой степени самодисциплины со стороны пациента.
Оплачивается ли участие?
Оплачивается ли участие?
Оплачиваться может только участие добровольца в Фазе І исследований (исследуемый препарат впервые принимается человеком).
- Все лабораторные и инструментальные обледования и лечение в рамках клинического испытания бесплатны для пациента.
- Существенные транспортные затраты участника, связанные с визитами на место проведения КИ, могут быть компенсированы.
Осуществляется ли контроль за проведением КИ в медицинских учреждениях в Украине?
Осуществляется ли контроль за проведением КИ в медицинских учреждениях в Украине?
Да.
Перед началом испытания Государственный Экспертный Центр МОЗ Украины дает разрешение на его проведение, а также свои положительные выводы предоставляет независимая этическая комиссия каждого медицинского учреждения, где планируется проведение КИ, после тщательного рассмотрения документов Заказчика.
В ходе испытания и еще длительное время после его завершения проводится ряд плановых и внеплановых «контрольных проверок качества» (аудитов и инспекций), как представителями Заказчика, Контрактной исследовательской организации, независимых аудиторских компаний, инспекторами Государственного Экспертного Центра Украины, так и инспекторами ведущих регуляторных органов (Европейское Медицинское Агентство (ЕМА) в сотрудничестве с регуляторным агентством США (FDA).